13天 笔记整理 最后冲刺
最后这几天都是自己复习,干脆整理笔记自用
加油
高考会赢的
📚本文目录
- 📚本文目录
- 🧪高中化学
- 反应类型 & 常见官能团 + 实例🌟🌟🌟🌟
- 有机化学中常见官能团与 Na、NaOH、NaHCO₃、Na₂CO₃ 的反应总结🌟
- 酸性的本质
- 元素周期律
- 原电池 电解池
- 🔎高中物理
- 🏃♀️运动学
- 平抛运动常考内容
- 基础 重中之重!
- 动能 能量及其守恒
- 平抛运动常考内容
- 🔍光学
- ⚡光的传播
- 🔍全反射相关🌟🌟
- 🌊波动光学(干涉与衍射)🌟
- 🔍透镜公式
- 各类光特点总结🌟🌟
- 🔥热力学
- 计算大题中常用公式🌟
- ⚡电学
- 电场中的物理量的关系图
- 理想变压器和长距离输电
- 理想变压器:(只对正弦交流起作用)
- 远距离输电:高压输电减少电压和功率损耗
- 🧲磁场 电生磁 磁生电
- 常用公式
- 🏃♀️运动学
- 📐高中数学
- 🔢数列复习
- 等差数列
- 等比数列
- 🧱立体几何体积面积公式🌟🌟🌟🌟🌟
- 🪙二项分布与超几何分布高考考点及解题总结
- 核心考点
- 解题方法与公式
- 典型例题参考
- 公式对比表
- 📐三角函数
- 解析几何
- 几何特征与推论
- 🔢数列复习
🧪高中化学
反应类型 & 常见官能团 + 实例🌟🌟🌟🌟
| 反应类型 | 能发生的常见官能团 | 反应条件 或 特点 | 例子 | 化学方程式 |
|---|---|---|---|---|
| 消去反应 | 醇(-OH)卤代烃(-X) | 醇:浓硫酸、加热(脱水)卤代烃:NaOH/醇溶液、加热(脱去HX) | 乙醇在浓硫酸170°C下生成乙烯 | C₂H₅OH → CH₂=CH₂ + H₂O(加热,浓H₂SO₄) |
| 加成反应 | 烯烃(C=C)、炔烃(C≡C)醛(-CHO)、酮(-CO-) | 常发生在不饱和键上;加 H₂、Br₂、HCl、H₂O 等 | 乙烯与溴加成生成1,2-二溴乙烷 | CH₂=CH₂ + Br₂ → CH₂BrCH₂Br |
| 取代反应 | 烷烃、苯及其衍生物(-Ph)醇(-OH)羧酸(-COOH)酯(-COO-) | 烷烃:光照下卤素取代芳香烃:催化剂、卤化剂、硝化等 | 甲烷在光照下与氯气反应生成氯甲烷 | CH₄ + Cl₂ → CH₃Cl + HCl(光照) |
| 氧化反应 | 醇(-OH)、烯烃(C=C)醛(-CHO)、芳香烃 | 醇 → 醛/酮/羧酸 需强氧化剂如KMnO₄/H⁺、K₂Cr₂O₇/H⁺ | 乙醇被酸性高锰酸钾氧化为乙酸 | CH₃CH₂OH + [O] → CH₃COOH + H₂O |
| 还原反应 | 醛(-CHO)、酮(-CO-)硝基苯、酰胺、腈等 | 还原剂如LiAlH₄、NaBH₄;催化剂还原如H₂/Ni | 乙醛被还原为乙醇 | CH₃CHO + H₂ → CH₃CH₂OH(催化剂Ni、加热) |
| 水解反应 | 卤代烃(-X)酯(-COO-、RCOOR’)酰胺(-CONH₂)、腈(-CN) | 碱性或酸性催化,加热 | 溴乙烷的水解生成乙醇 | C₂H₅Br + H₂O(碱性)→ C₂H₅OH + HBr |
| 酯化反应 | 醇(-OH)与羧酸(-COOH) | 浓硫酸,加热;可逆反应 | 乙醇与乙酸反应生成乙酸乙酯 | CH₃CH₂OH + CH₃COOH ⇌ CH₃COOCH₂CH₃ + H₂O(浓H₂SO₄) |
| 水解/皂化 | 酯(-COO-):特别处理 – 油脂 | NaOH溶液、加热 | 向酯中加入NaOH生成羧酸盐和醇 | CH₃COOCH₂CH₃ + NaOH → CH₃COONa + CH₃CH₂OH |
| 显色反应 | 酚(-Ph-OH) 淀粉(糖类)蛋白质(-CONH-) | 与FeCl₃作用显紫蓝色(苯酚)遇碘显蓝(淀粉)遇浓硝酸显黄(蛋白质) | 苯酚与三氯化铁反应显紫蓝色 | C₆H₅OH + FeCl₃ → 紫蓝色络合物 |
| 卤化反应 | 烷烃、苯、醇 | 光照(烷烃),催化剂(苯),HBr等(醇) | 光照下甲烷与氯气反应生成氯甲烷 | CH₄ + Cl₂ → CH₃Cl + HCl(光照) |
| 硝化反应 | 苯及其衍生物 | 浓硝酸 + 浓硫酸,加热 | 苯硝化生成硝基苯 | C₆H₆ + HNO₃ → C₆H₅NO₂ + H₂O(浓H₂SO₄,加热) |
| 加聚反应 | 烯烃(C=C)、某些炔烃(C≡C) | 引发剂、加压、加热 | 乙烯加聚成聚乙烯 | nCH₂=CH₂ → [–CH₂–CH₂–]n |
| 缩聚反应 | 二元羧酸与二元醇/二元胺 | 催化剂、高温、逐步反应 | 对苯二甲酸与乙二醇缩聚成PET | HOOC–Ph–COOH + HOCH₂CH₂OH → [–OC–Ph–COOCH₂CH₂O–]n + (2n–1) H₂O |
有机化学中常见官能团与 Na、NaOH、NaHCO₃、Na₂CO₃ 的反应总结🌟
| 官能团类别 | 与 Na 反应 | 与NaOH溶液反应 | 与NaHCO₃反应 | 与Na₂CO₃反应 | 主要产物 | 反应重要说明/规律 |
|---|---|---|---|---|---|---|
| 烷烃(-CH₃, -CH₂-) | ❌ 否 | ❌ 否 | ❌ 否 | ❌ 否 | 无 | 通常不显酸性,任何试剂都无明显反应 |
| 烯烃(C=C) | ❌ 否 | ❌ 否 | ❌ 否 | ❌ 否 | 无 | 性质稳定,不因弱酸碱与金属及盐反应 |
| 炔烃(C≡C) | ❌ 否 | ❌ 否 | ❌ 否 | ❌ 否 | 无 | 通常不反应,某些末端炔如HC≡CH可与NaNH₂反应,但不考这类。 |
| 卤代烃(-X) | ❌ 否 | ✅ 是 | ❌ 否 | ❌ 否 | 醇 / 酚 | 水解或亲核取代(如NaOH + CH₃CH₂Cl → CH₃CH₂OH + NaCl) |
| 醇(R–OH) | ✅ 是 | ❌ 否 | ❌ 否 | ❌ 否 | 醇钠、H₂ ↑ | R–OH + Na → R–ONa + ½H₂↑酸性弱,仅与Na反应 |
| 酚(Ar–OH) | ✅ 是 | ✅ 是 | ❌ 否 | ✅ 是 | 酚钠(Ar-ONa)NaHCO₃(只与Na₂CO₃) | 酚酸性比醇强,而弱于碳酸,故不与NaHCO₃反应,但可以与NaOH、Na₂CO₃反应 |
| 羧酸(R–COOH) | ✅ 是 | ✅ 是 | ✅ 是 | ✅ 是 | 羧酸钠、CO₂ ↑、H₂O、H₂ ↑ | 酸性强,反应均明显:R–COOH + NaHCO₃ → R–COONa + CO₂ ↑ |
| 酯(R–COOR’) | ❌ 否 | ✅(可水解) | ❌ 否 | ❌ 否 | 羧酸盐、醇 | 条件:NaOH加热 R–COOR' + NaOH → R–COONa + R’–OH |
| 醛(R–CHO) | ❌ 否 | ❌ 否 | ❌ 否 | ❌ 否 | 无反应 | 仅有锡/酸某些反应涉及,但一般不与Na、NaOH、碳酸盐直接反应 |
| 酮(R–CO–R’) | ❌ 否 | ❌ 否 | ❌ 否 | ❌ 否 | 无反应 | 不显酸性,隐藏官能团需深入反应才能辨别 |
| 氨基(-NH₂) | ❌ 否 | (可参与水解) | ❌ 否 | ❌ 否 | 季铵系,碱性弱反作用 | 若是酰胺,遇强碱可部分缓慢反应 (如苯甲酰胺 + 4NaOH → ...等) |
| 硝基苯类(-NO₂) | ❌ 否 | ❌ 否 | ❌ 否 | ❌ 否 | 无反应 | 有一定的酸性但用其他试剂作用;弱反应 |
选择题:含氧烃的衍生物
酸性的本质
酸的定义:在水溶液中电离出的阳离子全部为氢离子(H⁺)的化合物 ,其本质特征是能够向溶液中提供H⁺。
显而易见,如果溶液越容易放出H⁺,则溶液的酸性越强。总结高中阶段所学的知识,可以总结出以下因素:
- 溶液电离程度
溶液越容易电离,电离程度越大,酸性越大
此外:
- 强酸 (如HCl、H₂SO₄、HNO₃)在水中完全电离 ,酸性强弱仅由浓度决定;
- 弱酸 (如CH₃COOH、H₂CO₃)在水中部分电离 ,酸性强弱由电离常数(Ka)决定;
- 酸性比较 需在相同条件 (同溶剂、同温度)下进行;
讲到溶剂,溶剂也是决定电离的一大因素
- 盐酸(HCl)在水中完全电离(强酸),但在冰醋酸中电离度显著降低;
- 醋酸(CH₃COOH)在水中为弱酸,但在液氨中可完全电离;
- 键的极性&中心原子性质
吸电子原子A-H键极性越强,酸性越强
中心原子吸电子能力越强,酸性越强
这些理论适用于有机酸 (如羧酸、酚类)和无机含氧酸 (如硫酸、硝酸)
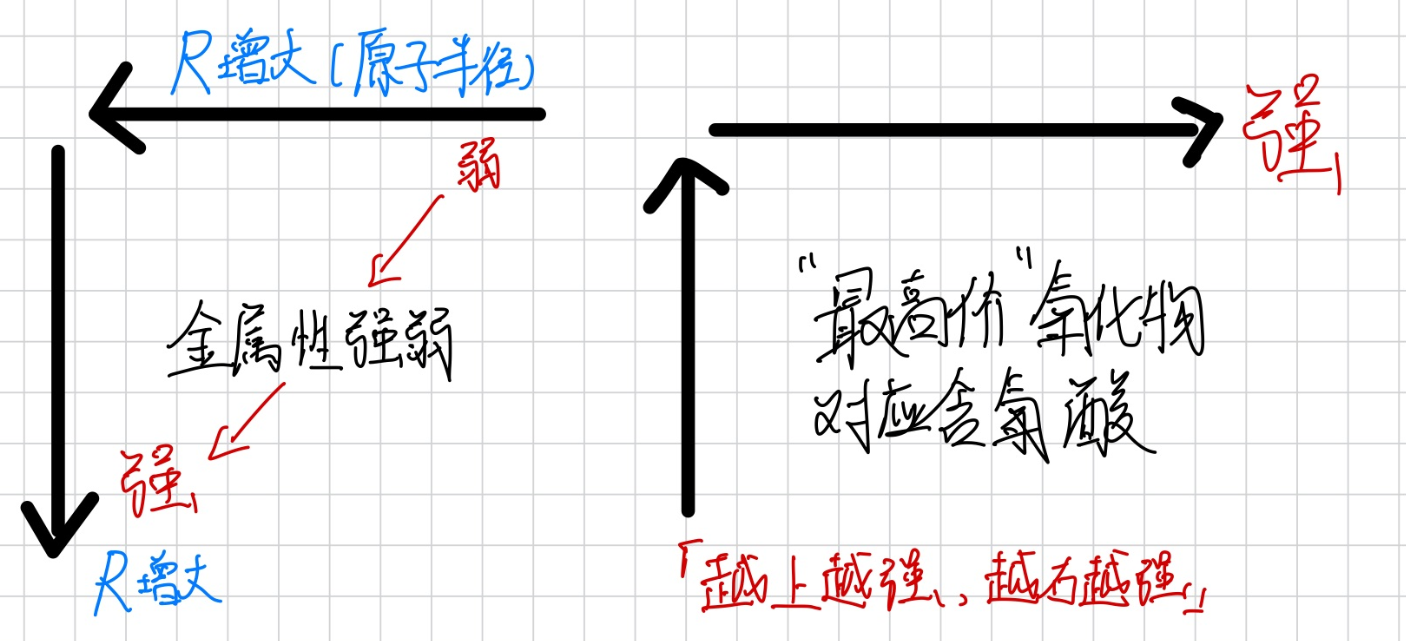
元素周期律
| 项目 | 内容 | 变化规律/应用 | 示例/说明 |
|---|---|---|---|
| 原子结构 | 原子序数=核电荷数=质子数=核外电子数(原子中) | 电子层数=周期序数;最外层电子数=主族序数 | H(1)、Li(2,1)、Na(2,8,1) |
| 周期性本质 | 元素性质随原子序数递增呈现周期性变化 | 核外电子排布的周期性变化 | 同周期从左到右金属性减弱,非金属性增强 |
| 金属性比较 | 单质置换能力、与水/酸反应剧烈程度、最高价氧化物水化物碱性强弱 | 同周期左→右减弱;同主族上→下增强 | Na>Mg>Al;LiCl>Br;N>O>F |
| 原子半径 | 电子层数越多半径越大;同周期核电荷越大半径越小 | 同周期左→右减小;同主族上→下增大 | Cl原子;阳离子<原子;同主族离子半径随原子序数增大 |
| 化合价 | 最高正价=族序数(O、F例外);最低负价=主族序数-8 | 主族元素常见化合价规律 | Cl最高+7(HClO₄),最低-1(HCl) |
| 最高价氧化物酸碱性 | 酸性:非金属氧化物对应含氧酸;碱性:金属氧化物对应氢氧化物 | 酸性同周期增强,同主族减弱;碱性反之 | HClO₄>H₂SO₄>H₃PO₄;NaOHHCl>HBr>HI |
简单画成图:
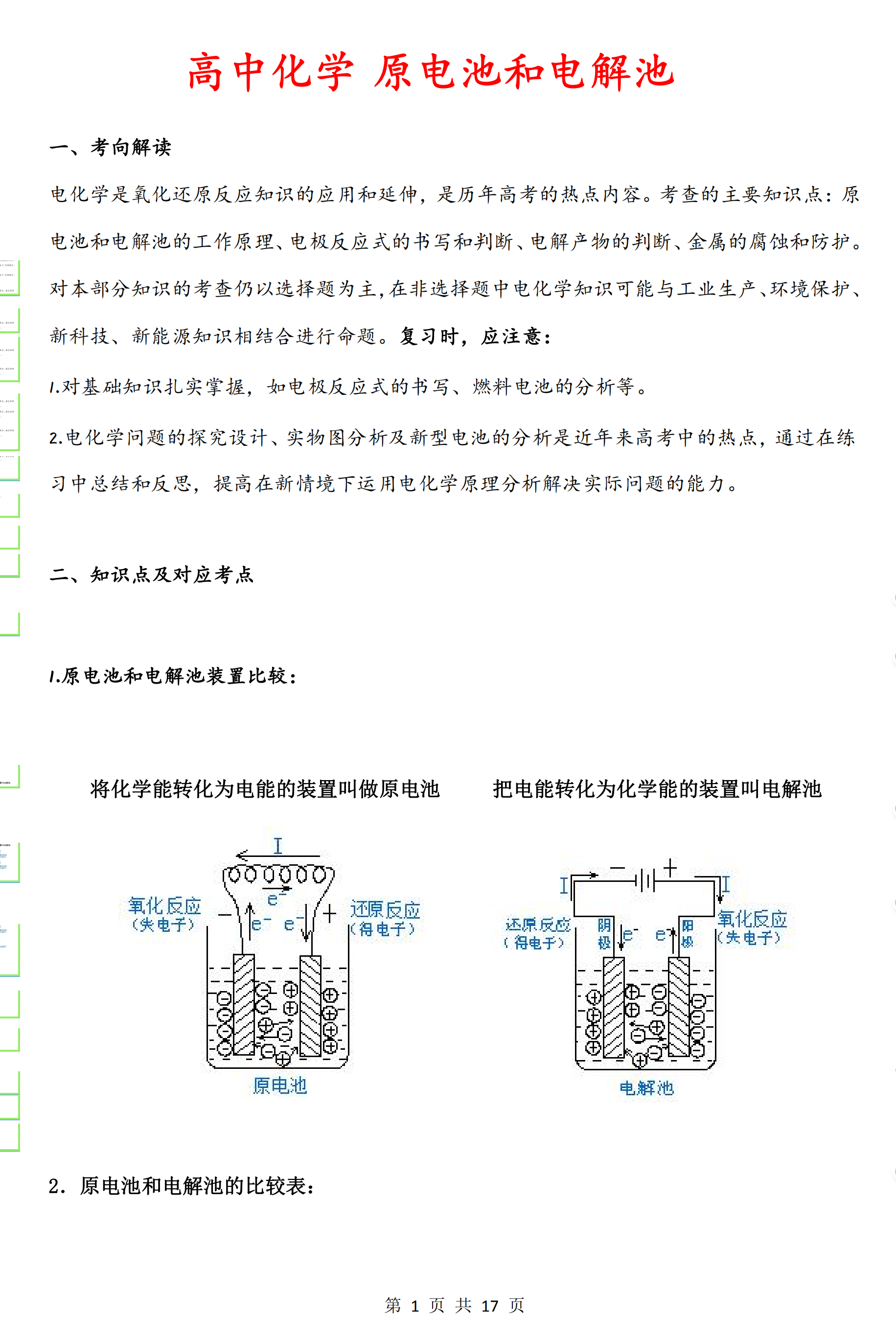
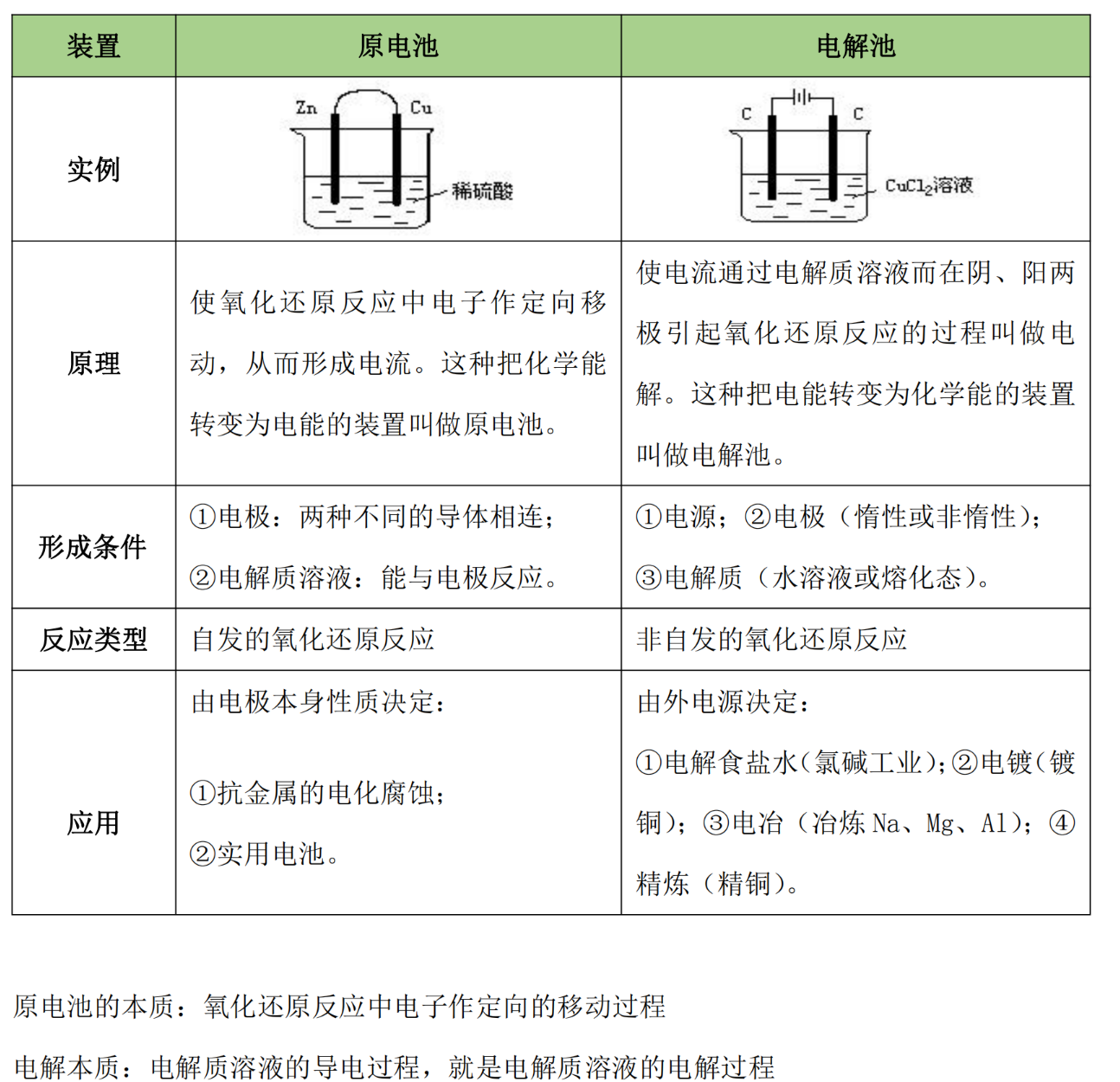
原电池 电解池
🔎高中物理
🏃♀️运动学
平抛运动常考内容
基础 重中之重!
平抛运动是匀变速运动,一般分解为水平的匀速运动和垂直的自由落体运动
推论可以不记,考试的时候可以把上面的公式联立得到推论。
动能 能量及其守恒
主要体型:
- 机车启动

🔍光学
⚡光的传播
| 公式 | 说明 |
|---|---|
c = 3×10⁸ m/s |
真空中的光速,常用于各种波光换算 |
n = c / v |
折射率定义式,n为介质折射率,v为介质光速 |
斯涅尔定律:n₁sinθ₁ = n₂sinθ₂ |
折射问题核心公式 |
🔍全反射相关🌟🌟
| 公式 | 说明 |
|---|---|
临界角:sin C = 1 / n |
当入射角 ≥ C 时,发生全反射 |
| 条件:光从光密介质 进入 光疏介质 | 如:从玻璃进入空气、从水进入空气 |
🌊波动光学(干涉与衍射)🌟
| 现象 | 公式 | 说明 |
|---|---|---|
| 双缝干涉亮条纹 | Δx = nλ |
路程差为波长整数倍时为亮条纹 |
| 双缝干涉暗条纹 | Δx = (2n + 1)λ/2 |
半波长奇数倍时为暗条纹 |
| 条纹间距公式 | Δx = Lλ / d |
L:双缝到光屏距离,d:双缝间距,λ:光波长 |
🔍透镜公式
| 公式 | 说明 | 备注 |
|---|---|---|
透镜成像公式:1/f = 1/u + 1/v |
f:焦距,u:物距,v:像距 | v为负数表示虚像,f为负表示凹透镜 (发散) |
各类光特点总结🌟🌟
| 光的类型 | 折射率 | 光速 | 临界角 |
|---|---|---|---|
| 红光 | 最小 | 在介质中最快 | 最大,易接近不发生反射情况 |
| 紫光 | 最大 | 在介质中光速最慢 | 最小,易发生全反射 |
🔥热力学
常考与选择题基础,大题第一题
计算大题中常用公式🌟
- 理想气体的状态
- 摄氏度与开尔文转换
- 压强公式
P=\frac{F}{S}
⚡电学
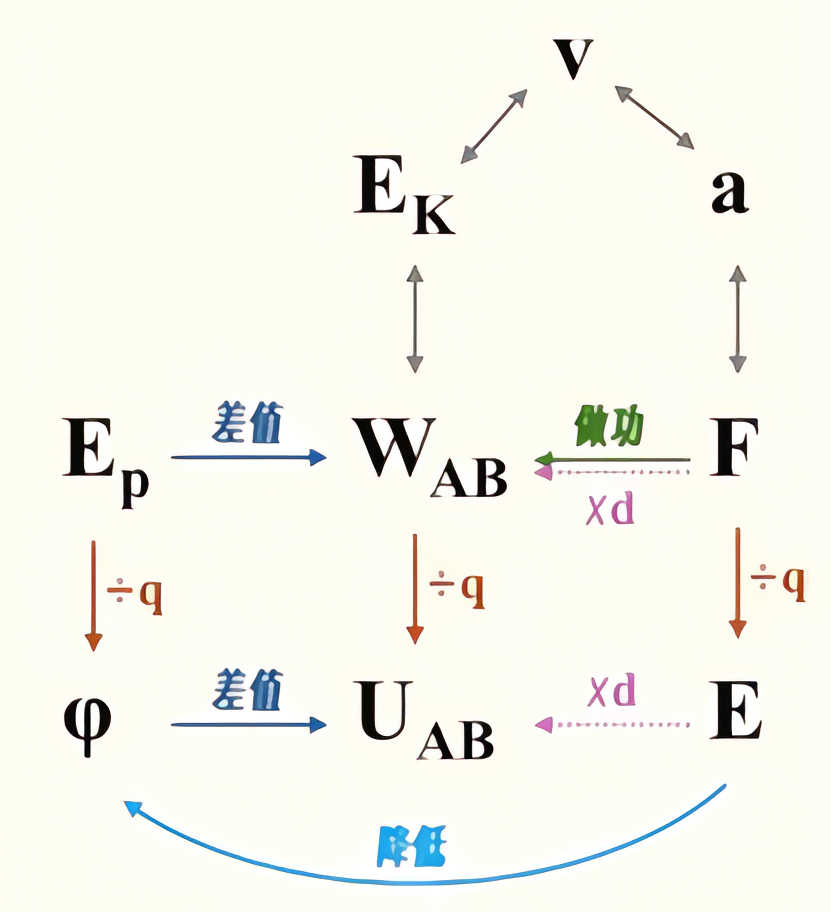
电场中的物理量的关系图
理想变压器和长距离输电
理想变压器:(只对正弦交流起作用)
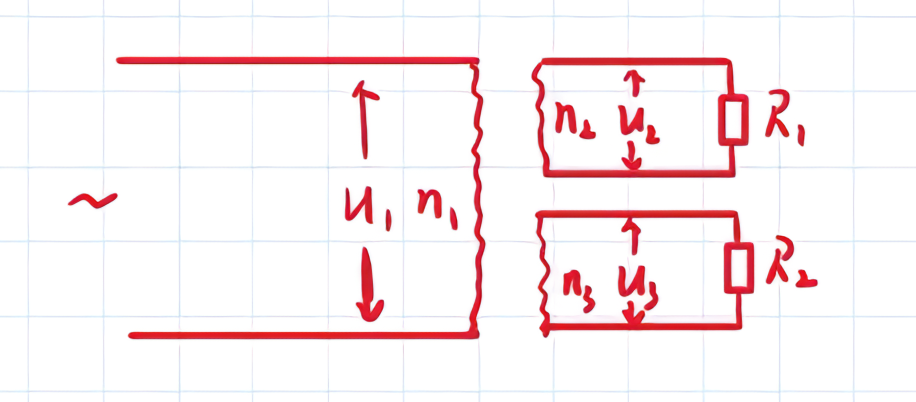
-
电压关系:原线圈电压决定副线圈电压
U_1 : U_2 = n_1 : n_2 \quad (\text{原理是电磁感应}) -
功率关系:副线圈功率等于原线圈功率
P_{\text{输入}} = P_{\text{输出}} \Rightarrow P_1 = P_2 + P_3 \quad (\text{原理是能量守恒}) -
电流关系:
P_1 = P_2 + P_3 \Rightarrow U_1 I_1 = U_2 I_2 + U_3 I_3单个副线圈:电流与匝数成反比
P_1 = P_2 \Rightarrow U_1 I_1 = U_2 I_2 \Rightarrow \frac{I_1}{I_2} = \frac{U_2}{U_1} = \frac{n_2}{n_1}
远距离输电:高压输电减少电压和功率损耗

-
电压关系:
\frac{U_1}{U_2} = \frac{n_1}{n_2}, \quad U_2 = U_3 + 2I_2 r, \quad \frac{U_3}{U_4} = \frac{n_3}{n_4} \quad (\text{电压从左边来}) -
功率关系:
P_1 = P_2, \quad P_2 = P_3 + 2I_2^2 r, \quad P_3 = P_4 \quad (\text{功率从左边来}) -
损耗电压和功率:
\Delta U = 2I_2 r, \quad \Delta P = 2I_2^2 r -
发电机电动势:
\mathcal{E}_m = nBS\omega, \quad \text{有效值 } U_m \text{ 不变} -
动态变化:
用户多用电 \rightarrow P_4 \uparrow \rightarrow P_3 \uparrow, P_2 \uparrow \rightarrow I_1, I_2 \uparrow \rightarrow U_2 = U_3 + 2I_2 r \uparrow \rightarrow U_3 \downarrow \rightarrow I_4 \downarrow
🧲磁场 电生磁 磁生电
常用公式
| 类别 | 公式 |
|---|---|
| 磁感应强度定义式 | B = \frac{F}{IL\sin\theta} |
| 洛伦兹力 | F = qvB\sin\theta |
| 圆周半径 | r = \frac{mv}{qB} |
| 周期 | T = \frac{2\pi m}{qB} |
| 安培力 | F = BIL\sin\theta |
| 磁通量 | \Phi = BS\cos\theta |
这部分我是真没咋学,考试前多看n遍这个视频吧


📐高中数学
🔢数列复习
等差数列
-
定义相邻两项的差为常数 d (公差)。
-
通项公式
a_n = a_1 + (n-1)d其中 a_1 为首项, d 为公差。
-
前 n 项和公式
S_n = \frac{n}{2}(a_1 + a_n) \newline \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ = na_1 + \frac{n(n-1)d}{2} -
等差中项若三数 a, A, b 成等差数列,则等差中项为:
A = \frac{a + b}{2} -
性质
- 任意两项满足 a_n - a_m = (n - m)d ( n > m )。
- 若 m + n = p + q ,则 a_m + a_n = a_p + a_q 。
- 单调性:当 d > 0 时,数列递增;当 d < 0 时,递减;当 d = 0 时,常数列。
等比数列
-
定义相邻两项的比为常数 q (公比, q \neq 0 )。
-
通项公式
a_n = a_1 \cdot q^{n-1}其中 a_1 为首项, q 为公比。
-
前 n 项和公式
- 当 q \neq 1 时:
S_n = a_1 \cdot \frac{1 - q^n}{1 - q} \\ \ \ \ \ \ \ = a_1 \cdot \frac{q^n - 1}{q - 1}
- 当 q = 1 时:
S_n = n \cdot a_1
- 当 q \neq 1 时:
🧱立体几何体积面积公式🌟🌟🌟🌟🌟
| 几何体 | 表面积公式 | 体积公式 | 说明 |
|---|---|---|---|
| 台体(如圆台、棱台) | 侧面积公式:
S_{\text{侧}} = \frac{(C_1 + C_2)}{2} \cdot l
总表面积:
S = S_{\text{上}} + S_{\text{下}} + S_{\text{侧}}
|
体积公式:
V = \frac{1}{3} h (S_{\text{上}} + S_{\text{下}} + \sqrt{S_{\text{上}} S_{\text{下}}})
|
- C_1, C_2 :上下底面周长- l :母线长(斜高)- S_{\text{上}}, S_{\text{下}} :上下底面积- h :高 |
| 球体 | 表面积:
S = 4\pi R^2
|
体积:
V = \frac{4}{3} \pi R^3
|
- R :球半径 |
| 锥体(如圆锥、棱锥) | 侧面积公式:
S_{\text{侧}} = \frac{1}{2} C \cdot l
(圆锥: S_{\text{侧}} = \pi r l )总表面积:
S = S_{\text{底}} + S_{\text{侧}}
|
体积:
V = \frac{1}{3} S_{\text{底}} \cdot h
|
- C :底面周长- l :母线长(圆锥的斜高)- S_{\text{底}} :底面积- h :高 |
🪙二项分布与超几何分布高考考点及解题总结
核心考点
-
二项分布🌟🌟🌟
- 定义:独立重复试验中,每次成功概率为 p ,重复 n 次,随机变量 X \sim B(n, p) 。
- 典型场景:抛硬币、射击命中、独立事件重复发生。
- 高频考法:
- 求分布列或特定概率值(如 P(X=k) );
- 计算期望 E(X) = np 和方差 D(X) = np(1-p) ;
- 结合实际问题建模(如疫苗有效率、产品质量检测)。
-
超几何分布🌟
- 定义:从含 M 个次品的 N 个物品中不放回抽取 n 个,随机变量 X \sim H(N, n, M) 。
- 典型场景:抽样检测、抽奖问题、有限总体的不放回抽样。
- 高频考法:
- 求分布列 P(X=k) = \frac{C(M,k) \cdot C(N-M, n-k)}{C(N,n)} ;
- 判断模型适用性(如“无放回”关键词);
- 与二项分布对比分析(样本容量较小时差异显著)。
解题方法与公式
-
二项分布公式
P(X=k) = C(n,k) \cdot p^k \cdot (1-p)^{n-k}- 期望: E(X) = np
- 方差: D(X) = np(1-p) 。
-
超几何分布公式
P(X=k) = \frac{C(M,k) \cdot C(N-M, n-k)}{C(N,n)}- 期望: E(X) = n \cdot \frac{M}{N}
- 方差: D(X) = n \cdot \frac{M}{N} \cdot \frac{N-M}{N} \cdot \frac{N-n}{N-1} (常简化为近似公式)。
-
关键解题步骤
- 判断分布类型:
- “独立重复”“成功率固定” → 二项分布;
- “无放回抽样”“有限总体” → 超几何分布。
- 列分布列:
- 二项分布直接套用公式;
- 超几何分布需枚举所有可能的 k 值并计算概率。
- 期望与方差:直接代入公式,无需推导。
- 判断分布类型:
典型例题参考
- 二项分布:
- 抛一枚硬币5次,求恰好3次正面的概率(答案: C(5,3) \cdot 0.5^5 )。
- 超几何分布:
- 盒中有10个球(3红7白),无放回取4个,求恰好2红球的概率(答案: \frac{C(3,2) \cdot C(7,2)}{C(10,4)} )。
公式对比表
| 分布类型 | 应用场景 | 是否独立 | 期望公式 | 方差公式 |
|---|---|---|---|---|
| 二项分布 | 独立重复试验 | 是 | np | np(1-p) |
| 超几何分布 | 无放回抽样 | 否 | n \cdot \frac{M}{N} | n \cdot \frac{M}{N} \cdot \frac{N-M}{N} \cdot \frac{N-n}{N-1} |
📐三角函数
多练!!
没有技巧,全是感情和泪
解析几何
| 曲线类型 | 标准方程 | 参数定义 | 关系式 | 说明 |
|---|---|---|---|---|
| 椭圆 | \displaystyle \frac{x^2}{a^2} + \frac{y^2}{b^2} = 1 (当 a > b 时) |
- a :长半轴长度 - b :短半轴长度 - c :焦点到中心的距离 |
c^2 = a^2 - b^2 | 焦点在长轴上(x轴方向) 若焦点在 y 轴,则 a > b 且标准形式为 \frac{y^2}{a^2} + \frac{x^2}{b^2} = 1 |
| 双曲线 | \displaystyle \frac{x^2}{a^2} - \frac{y^2}{b^2} = 1 | - a :实半轴长度 - b :虚半轴长度 - c :焦点到中心的距离 |
c^2 = a^2 + b^2 | 焦点在实轴上(x轴方向) 若焦点在 y 轴,则标准形式为\frac{y^2}{a^2} - \frac{x^2}{b^2} = 1 |
| 抛物线 | y^2 = 2px 或 x^2 = 2py | - 不涉及 a, b, c 这样的统一参数 | —— | 抛物线一般不使用 a, b, c 表示,而是用焦距 p |
补充说明:
- 椭圆的离心率: e = \frac{c}{a} ,其中 0 < e < 1
- 双曲线的离心率: e = \frac{c}{a} ,其中 e > 1
- 圆是特殊的椭圆,满足 a = b ,此时 c = 0
几何特征与推论
| 曲线类型 | 几何特征/推论 | 说明 |
|---|---|---|
| 椭圆 | 离心率 e = \frac{c}{a} < 1 | 描述椭圆的扁平程度, c = \sqrt{a^2 - b^2} |
| 长轴、短轴 | 长轴为 2a ,短轴为 2b ,中心在原点或对称中心 | |
| 焦点 | 焦点在长轴上,距离中心为 c | |
| 通径 | 椭圆通径长度为 \frac{2b^2}{a} | |
| 对称性 | 关于 x 轴、y 轴及原点对称 | |
| 准线 | 两条准线方程为 x = \pm \frac{a}{e} 或 y = \pm \frac{a}{e} |
| 曲线类型 | 几何特征/推论 | 说明 |
|---|---|---|
| 双曲线 | 离心率 e = \frac{c}{a} > 1 | 表示双曲线张开的程度, c = \sqrt{a^2 + b^2} |
| 实轴、虚轴 | 实轴长度为 2a ,虚轴长度为 2b | |
| 渐近线 | 双曲线的渐近线方程为 y = \pm \frac{b}{a}x 或 x = \pm \frac{b}{a}y | |
| 焦点 | 在实轴上,距离中心为 c | |
| 通径 | 双曲线通径长度为 \frac{2b^2}{a} | |
| 对称性 | 关于 x 轴、y 轴及原点对称 | |
| 准线 | 准线方程为 x = \pm \frac{a}{e} 或 y = \pm \frac{a}{e} |
| 曲线类型 | 几何特征/推论 | 说明 |
|---|---|---|
| 抛物线 | 开口方向 | 由标准方程 y^2 = 2px 或 x^2 = 2py 决定 |
| 焦点 | 如 y^2 = 2px 的焦点为 (p, 0) | |
| 准线 | 如 y^2 = 2px 的准线为 x = -p | |
| 通径 | 抛物线通径长度为 2p |